欢迎光临药得网站!
甲磺酸伊马替尼片/格列卫/Imatinib/Gleevec
片剂
0.1g*60片
36个月
Novartis Pharma Produktions GmbH
德国
详询客服
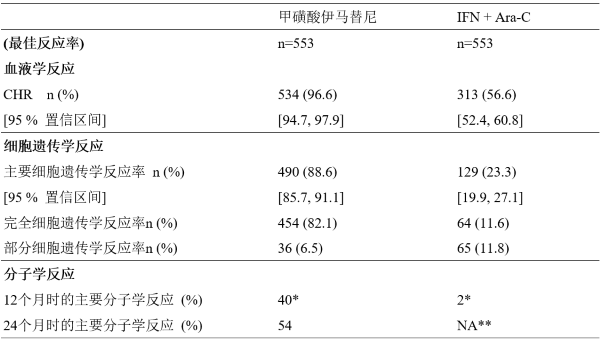
新诊断CML实验研究中的反应结果如下表(60个月时的数据)
另一项CML慢性期(15人)或CML急变期或费城染色体阳性的急性白血病(16人)共31名儿童患者入组剂量递增的I期试验,这些患者既往曾接受过多次治疗,其中45%接受过骨髓移植,68%接受过多种药物化疗。患者按下列剂量接受伊马替尼治疗,260 mg/m2/天、340 mg/m2/天、440 mg/m2/天和570 mg/m2/天。在获得了细胞遗传学资料的13例CML患者中,7例(54%)获得了完全细胞遗传学反应,4例(31%)获得部分细胞遗传学反应,相当于85%获得了主要细胞遗传学反应。
2. 胃肠道间质瘤(GIST)的临床研究
对不能手术切除或转移的胃肠道间质肿瘤(GIST)患者进行了一项开放、随机、多国家参加的II期临床试验。
两个剂量组人群的 反应率没有明显不同,随着治疗时间延长,很多在中期分析时疾病稳定的患者获得了部分反应(中位随访时间31个月)。至疾病反应的中位时间为13周(95% C.I.:12~23),至治疗失败的中位时间为122周(95% C.I.:106~147),整体研究是84周(95% C.I.:71~109)。总体中位生存率数据还未完成;随访36个月时,Kaplan-Meier生存分析估计生存率为68%。达到疾病稳定和部分反应的患者,其生存时间无统计学差异。
两个临床试验(B2222和S0033研究)中,患者接受400 mg/天或600 mg/天的起始剂量治疗,疾病进展时,剂量增加至800 mg/天。总共有103例患者的剂量增加到800 mg/天,增加剂量后,6例患者出现了部分反应,21例患者出现了疾病稳定,总的临床获益率为26%。从目前已知的安全性资料,增加剂量到800 mg/天似乎并没有影响到本品的治疗安全性。
3. 胃肠道间质瘤(GIST)辅助治疗的临床研究
在一项有713名患者参加的多中心、双盲、安慰剂对照、随机研究(Z9001)中对格列卫的辅助治疗进行了研究。
研究的有效性终点为无复发生存期(RFS),为随机日至复发日或任何原因死亡日期之间的时间。
伊马替尼显著延长了RFS,伊马替尼组患者中75%在第38个月时未发生复发,而安慰剂组为20个月(95% CIs, [30-不可估计]; [14-不可估计]; (HR= 0.398[0.259~0.610],p<0.0001))。伊马替尼组12个月的RFS明显优于安慰剂组,其RFS分别为97.7%和82.3%(P<0.0001)。与安慰剂组相比,在前12个月期间GIST复发的相对风险降低89%(HR= 0.113;95% CI:0.049~0.264)。
根据NIH及AFIP风险分类所进行的亚组分析如下表述。低复发风险的患者不能从该辅助治疗中得到临床获益。
按NIH和AFIP风险分类标准的Z9001试验RFS分析总结
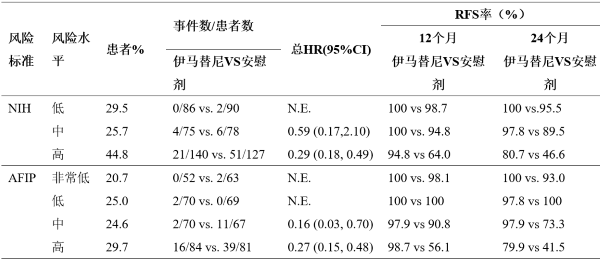
* 整个随访阶段
N.E.=不可估计
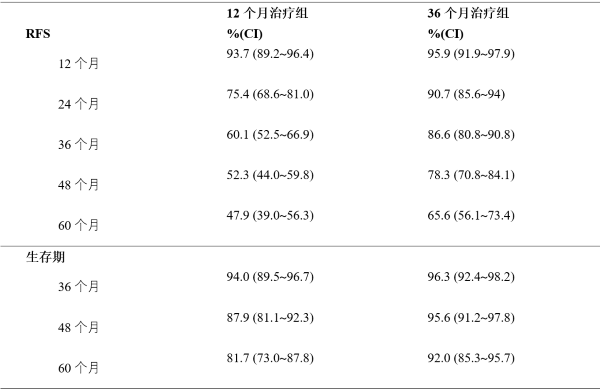
另一项开放性III期研究(SSG XVIII/AIO)对比了伊马替尼400mg/日剂量的为期12个月治疗与为期36个月治疗,该研究在GIST切除术后并存在以下任何一种情况的患者中进行:肿瘤直径>5cm,高倍镜视野(HPF)下有丝分裂数>5/50;或肿瘤直径>10cm,任意有丝分裂数;或任意肿瘤大小,有丝分裂数>10/50 HPF或肿瘤破裂进入腹膜腔。
研究的主要终点是无复发生存期(RFS),定义为从随机日期至复发或因任何原因死亡的日期。
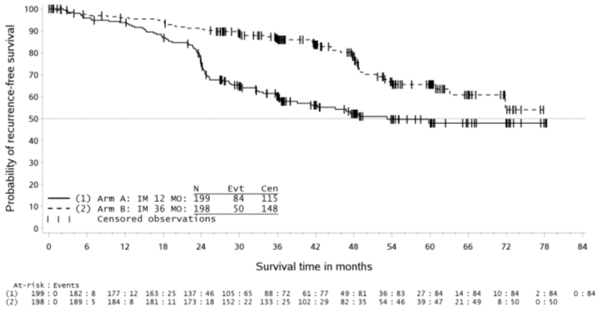
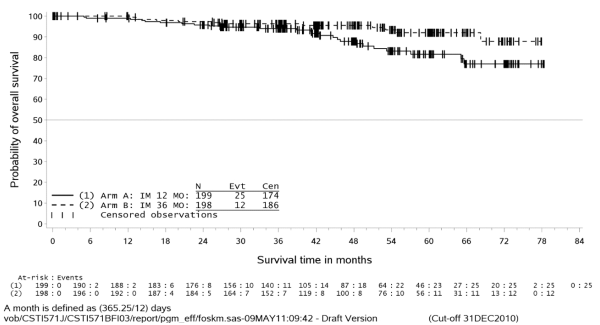
与12个月治疗组相比,36个月治疗组的RFS显著延长(总风险比(HR)=0.46 [0.32, 0.65],p<0.0001,超过12个月的HR=0.42 [0.28, 0.61])。12个月治疗组和36个月治疗组的RFS事件总数分别为84 (42%)和50 (25%)。
另外,与12个月治疗组相比,36个月治疗组的总生存期(OS)显著延长(HR=0.45 [0.22, 0.89], p=0.0187)。12个月治疗组的死亡事件总数是25例,36个月治疗组是12例。
为期12个月和36个月的伊马替尼治疗(SSGXVIII/AIO试验)
主要终点无复发生存期的Kaplan-Meier估计(ITT 群体)
总生存期的Kaplan-Meier估计(ITT群体)
4.Ph+ALL的临床研究
成人Ph+ALL
对总共48名复发/难治性费城染色体阳性的急性淋巴细胞性白血病(Ph+ ALL)患者进行研究(0109),其中有43名患者接受伊马替尼推荐剂量600 mg/天。另外有2名复发/难治性Ph+ ALL患者在一项I期研究中接受伊马替尼600 mg/天。
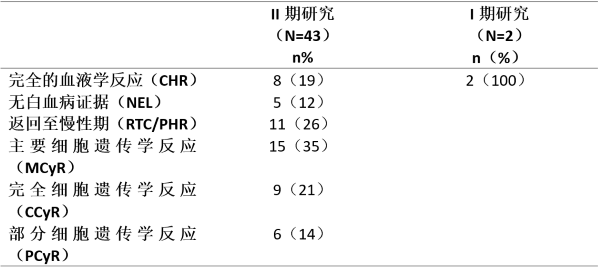
II期研究43名复发/难治性Ph+ALL患者和I期研究2名复发/难治性Ph+ALL患者中确认的和未确认的血液学和细胞遗传学反应率见下表。血液学反应的中位持续时间为3.4个月,MCyR的中位持续时间为2.3个月。
伊马替尼对复发/难治性Ph+ALL的作用
儿童Ph+ALL
一项多中心、非随机化的协作组研究(I2301)中入选了高危ALL儿童和青年患者,高危ALL定义为诱导治疗后预期5年无事件生存率(EFS)低于45%。
在Ph+ALL患者亚组中评价伊马替尼(340 mg/m2/天)联合强化化疗的安全性和有效性。方案包括强化化疗和有适当的HLA匹配的家族供者的患者中2个化疗疗程后进行造血干细胞移植。入选了92名合格的Ph+ ALL患者。中位年龄为9.5岁(1至21岁:1-<2岁,2.2%;2-<12岁,56.5%;12-<18岁,34.8%;和18-21岁,6.5%)。有64%的患者为男性;有75%的患者为白人、有9%的患者为亚洲人/太平洋岛民和有5%的患者为黑人。在5个连续队列中,通过提前开始治疗和延长治疗时间系统地增加伊马替尼的暴露。队列1接受最低强度和队列5接受最高强度的伊马替尼暴露。
有50名Ph+ALL患者被分配至队列5接受伊马替尼强化疗治疗;有30名仅接受化疗和伊马替尼治疗,有20名先是接受化疗和伊马替尼治疗,接着进行造血干细胞移植,然后接受进一步的伊马替尼治疗。队列5中接受化疗治疗的患者从诱导后化疗第一个疗程开始直至化疗维持疗程1至4接受伊马替尼每天一次连续暴露。在维持疗程5至12期间,56天疗程的28天中给予伊马替尼。行造血干细胞移植的患者在HSCT前接受42天伊马替尼治疗和在HSCT后接受28周(196天)伊马替尼治疗。队列5患者中估计4年EFS为70%(95%CI:54,81)。数据截止时队列5患者中EFS中位随访时间为40.5个月。
5. HES/CEL的临床研究
在一项开放性、多中心II期临床研究中(B2225),考察甲磺酸伊马替尼治疗与ABL、Kit或PDGFR蛋白酪氨酸激酶相关的、威胁生命的疾病的疗效和安全性。
文献报道中患者的反应持续时间范围是6+周至44个月。
HES/CEL的反应率
6. MDS/MPD的临床研究
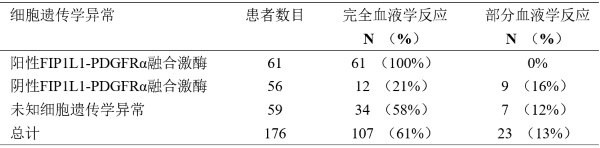
在一项开放的、多中心II期临床研究中(B2225),考察甲磺酸伊马替尼治疗与ABL、Kit或PDGFR蛋白酪氨酸激酶相关的、威胁生命的疾病的疗效和安全性。这项研究包括了7例骨髓增生异常综合征/骨髓增殖性疾病(MDS/MPD)患者。这些患者接受甲磺酸伊马替尼每日400mg治疗,患者的年龄范围是20至86岁。
在II期研究中接受治疗的7例患者的中位治疗时间是12.9个月(0.8~26.7),在已发表的文献中,有反应的患者的中位治疗时间范围在1周至18个月以上,结果见下表。在II期研究中反应的持续时间是141+天至457+天。
MDS/MPD的反应率
7. ASM的临床研究
在一项开放性、多中心II期临床研究中(B2225),考察甲磺酸伊马替尼治疗与ABL、Kit或PDGFR蛋白酪氨酸激酶相关的、威胁生命的疾病的疗效和安全性。这项研究包括5例侵袭性系统性肥大细胞增生症(ASM)患者,这些患者接受甲磺酸伊马替尼的剂量为每日100 mg至400 mg,年龄范围是49至74岁。
在II期研究中,5例ASM患者接受甲磺酸伊马替尼治疗的中位时间是13个月(范围是1.4~22.3个月),在已发表的医学文献中所报道的出现反应的患者,这个中位时间在1个月至30个月以上。ASM患者对甲磺酸伊马替尼的反应率见下表。文献中患者的反应持续时间范围是1个月至超过30个月。
ASM的反应率
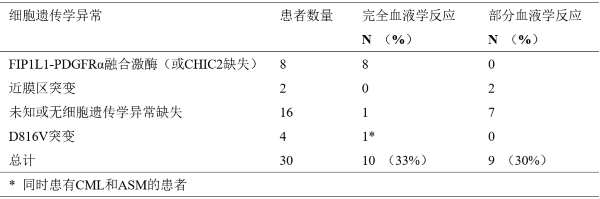
对于侵袭性小的系统性肥大细胞增多症(SM),甲磺酸伊马替尼未显示有效。所以,不建议将甲磺酸伊马替尼用于皮肤肥大细胞增生病、静止性系统性肥大细胞增多症(隐袭性SM或单纯性骨髓肥大细胞增生症),伴有相关的克隆性血液的非肥大细胞系疾病的SM、肥大细胞白血病、肥大细胞肉瘤或皮肤外肥大细胞瘤。有D816V c-Kit突变的患者对甲磺酸伊马替尼不敏感,不应该接受甲磺酸伊马替尼治疗。
8.DFSP的临床研究
隆突性皮肤纤维肉瘤(DFSP)是一种皮肤软组织肉瘤。它的特征是染色体17和22易位,引起α1Ⅰ型胶原基因和PDGF B基因融合。
在一项开放的、多中心II期临床研究中(B2225),考察甲磺酸伊马替尼治疗与ABL、Kit或PDGFR蛋白酪氨酸激酶相关的、威胁生命的疾病的疗效和安全性。这项研究入组了12例初始手术切除之后局部复发且进一步手术不能带来临床获益的转移性DFSP患者。他们接受甲磺酸伊马替尼每日800 mg治疗(年龄范围23至75岁)。
在已发表的文献中,成年患者接受甲磺酸伊马替尼治疗剂量是400mg/日(4个病例)或是800mg/日(1个病例)。一个儿科患者接受400 mg/m2/日,随后增加至520 mg/m2/日。10例患者有PDGF B基因重排,5例患者没有可获取的细胞遗传学数据,3例患者有复杂的细胞遗传学异常。对治疗的反应见下表。
DFSP的反应率


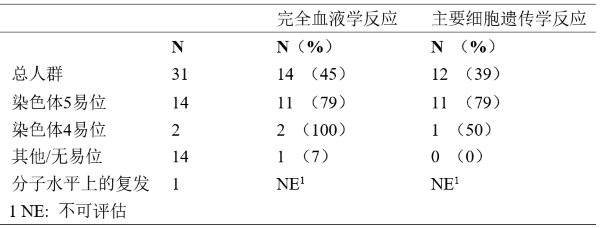
18例患者中的12例或者达到完全反应(7例患者)或者在部分反应之后通过手术达到无疾病生存(5例患者,包括1例儿童),使得总的完全反应率达到67%。还有3例患者达到部分反应,使得总反应率达到83%。在有转移性疾病的8例患者中,5例患者出现反应(62%),其中3例患者为完全反应(37%)。在10例有PDGF B基因重排的患者中,4例完全反应,6例部分反应。在II期研究中治疗的中位持续时间是6.2个月,最大持续时间是24.3个月,而在已发表的文献中,这种持续时间范围是4周至20月以上。
9. 肝功能不全患者的临床研究
一项以不同程度肝功能不全患者(轻度、中度和重度)为研究对象的试验中,平均伊马替尼暴露量(标准剂量AUC)与肝功能正常的患者相比无增加。该研究中,500 mg 每天一次可安全用于轻度肝功能不全患者,300 mg 每天一次对其它肝功能不全患者亦是安全的。尽管在中重度肝功能不全患者中仅采用了300 mg 每天一次的剂量,但是药代动力学分析表明400 mg这一剂量水平同样是安全的。
10. 肾功能不全患者的临床研究
一项以不同程度肾功能不全患者(轻度、中度和重度)为研究对象的试验中,平均伊马替尼暴露量(标准剂量AUC)与肾功能正常的患者相比增加了1.5-2倍,与血浆AGP- 一种与伊马替尼牢固结合的蛋白-水平的升高相符。尚未发现伊马替尼暴露量与肾功能不全的严重程度存在相关性。在本研究中,800 mg每日一次可安全用于轻度肾功能不全患者,而600 mg 每日一次对中度肾功能不全患者亦是安全的。由于纳入试验的患者例数有限,目前尚未在中度肾功能不全患者中进行800 mg剂量水平的研究。仅有2例严重肾功能不全的患者纳入研究并接受低剂量(100 mg)治疗,未进行较高剂量的评价。研究中未纳入正在进行血液透析的患者。文献资料表明一例正接受血液透析治疗的晚期肾病患者对400 mg这一剂量的耐受性很好。该患者的PK血浆暴露量落在肾功能正常的伊马替尼及其代谢产物CGP74588的范围内,尚未发现透析影响伊马替尼的血浆动力学。由于伊马替尼几乎不经肾脏排泄,故严重肾功能不全及正接受透析治疗的患者可接受起始剂量为400 mg的治疗。然而,对于这些患者,仍需慎重。如果不能耐受,可减量;疗效欠佳,可增加剂量。
免责声明:由本文所表达的任何关于疾病的建议都不应该被视为医生的建议或替代品,请咨询您的治疗医生了解更多细节。本站信息仅供参考,药得不承担任何责任。