欢迎光临药得网站!
维奈克拉片/维奈托克/维奈妥拉/维纳妥拉/维特克拉/Venetoclax Tablets
片剂
10 mg*14片; 50 mg*7片; 100 mg*14片;100 mg*28片
24个月(10mg和50mg); 36个月 (100mg)
ABBVIE INC 艾伯维
爱尔兰
详询客服
本品是一种BCL-2抑制剂:
•用于治疗慢性淋巴细胞白血病(CLL)或小淋巴细胞淋巴瘤(SLL)的成人患者。
•与阿扎胞苷(azacytidine)、地西他滨(decitabine)或小剂量阿糖胞苷(cytarabine)联合治疗75岁或以上的新诊断急性髓细胞白血病(AML),或因合并症排除使用强化诱导化疗的患者。
【推荐剂量】
1. 慢性淋巴细胞白血病/小淋巴细胞淋巴瘤的推荐剂量
本品给药由为期5周的剂量调整期开始。
本品为期5周剂量调整期之用药时程:
本品剂量必须依据每周剂量调整时程,在5周内达到建议剂量每日400mg,如表1所示。5周的剂量调整时程,目的是逐渐降低肿瘤负荷(减少体积),以减少肿瘤溶解症候群(TLS)的风险。
表1. CLL/SLL患者5周递增期给药计划

CLL/SLL患者的起始给药将依据剂量调整时程,提供最初4周的VENCLEXTA使用剂量。当达到每日400mg目标剂量后,则开始服用瓶装之每颗100mg片剂。
联合奥滨尤妥珠单抗(Obinutuzumab)
在第一个疗程的第1天开始给予奥滨尤妥珠单抗(Obinutuzumab)100mg,然后在第一个疗程的第2天开始给予900mg。在第一个疗程的的第8天和第15天以及随后每个28天为1疗程的第1天使用1000mg,共6个周期。有关其他剂量信息,请参阅奥滨尤妥珠单抗(Obinutuzumab)处方信息。
在第一个疗程的第22天,根据5周递增剂量计划(见表1)启动VENCLEXTA。在第2疗程的第28天完成递增剂量计划后,从第3疗程第1天开始至第12疗程的最后一天,继续以400mg的剂量口服VENCLEXTA,每天一次。
联合利妥昔单抗(rituximab)
在患者完成5周的VENCLEXTA递增给药计划(见表1),并连续7天每天口服一次推荐剂量为400 mg的 VENCLEXTA后,开始利妥昔单抗(rituximab)给药。在每个28天为1疗程的第1天给予利妥昔单抗(rituximab)6个疗程,第1疗程的静脉输注剂量为375 mg/m2,第2-6周期静脉输注剂量为500 mg/ m2。从利妥昔单抗(rituximab)第1疗程第1天开始,连续24个月每天一次口服400mgVENCLEXTA。
本品单一药物治疗
当病人剂量调整期结束后,VENCLEXTA的建议剂量为每日400mg。VENCLEXTA应每日一次口服使用,直到出现疾病进展或无法耐受的毒性。
2. 急性髓性白血病的推荐剂量
本品的推荐剂量和剂量增加取决于联用的药物。如表2所示,遵循给药计划,包括3天或4天剂量递增。在第1的疗程的第1天开始服用VENCLEXTA,并结合:
•阿扎胞苷(azacytidine)75 mg/ m2静脉或皮下注射,每天一次,每28天疗程的第1-7天;或
•地西他滨(decitabine)20 mg/ m2,静脉使用每天1次,每28天疗程的第1-5天;或
•阿糖胞苷(cytarabine)20 mg/ m2皮下注射,每天一次,每28天疗程的第1-10天。
表2. 急性髓细胞白血病患者3天或4天剂量调整期的给药计划

与阿扎胞苷(azacytidine)、地西他滨(decitabine)或小剂量阿糖胞苷(cytarabine)联用时,继续使用本品直至疾病进展或出现不可耐受的毒性。
3. 肿瘤溶解症候群(TLS)风险评估及预防
接受本品治疗的病人可能会发生肿瘤溶解症候群(TLS),请参阅下列对应之信息以采取适当处置。考虑病人特异性因素,以评估肿瘤溶解症候群(TLS)的风险高低的程度,并在使用本品第一剂治疗前,预防性补充水分及施用降尿酸药物,以降低肿瘤溶解症候群(TLS)风险。
慢性淋巴细胞白血病(CLL)/小淋巴细胞淋巴瘤(SLL)
VENCLEXTA可能造成肿瘤快速缩减,因此在最初5周的剂量调整期,有肿瘤溶解症候群(TLS) 的风险。符合肿瘤溶解症候群而需要立即采取处置的血液学生化变化,可能在第一剂VENCLEXTA之后6至8小时就发生,也可能在每个剂量调升时发生。TLS也可能发生在剂量中断后恢复VENCLEXTA。停药后的剂量调整见表4和表5。
TLS的风险是一个基于多种因素的连续体,特别是肾功能降低(肌酐清除率<80 mL/min)和肿瘤负荷;脾肿大也可能增加TLS的风险。
进行肿瘤负荷评估,包括放射线影像学评估(如CT扫描),评估所有患者的血液生化(钾、尿酸、磷、钙和肌酐),并在开始使用VENCLEXTA治疗前纠正先前存在的异常。随着肿瘤负担的减轻,风险可能会降低。
下表表3描述了根据临床试验数据确定的肿瘤负荷,在VENCLEXTA治疗期间推荐的TLS预防和监测。在最终确定预防和监测时间表之前,考虑所有患者的合并症。当在5周剂量调整期期间停药超过1周或完成5周剂量调整期后停药超过2周时,重新评估停药风险。根据需要进行预防和监测。
表3. 基于CLL/SLL患者肿瘤负荷的TLS预防建议
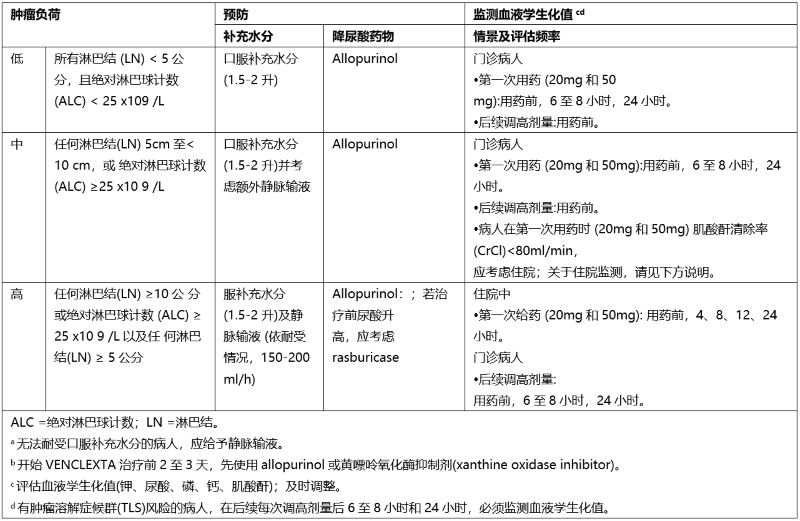
• 任何病人在接受VENCLEXTA治疗前的白血球计数必须< 25 × 109/L且可能必须于治疗前进行细胞减积手术。
• 所有病人在VENCLEXTA第一剂治疗前及剂量调整期间,必须预防性的补充水分及施用降尿酸药物。
• 在VENCLEXTA第一剂治疗前必须进行血液学生化评估 (钾、尿酸、磷、钙、肌酸酐),并将原有异常进行调整。
• 为预防肿瘤溶解症候群(TLS),在给药前、后续每次调高剂量后6至8小时及到达最终剂量后24小时,都必须监测血液学生化值。
• 有肿瘤溶解症候群(TLS)风险的病人(例如:血液检测出现芽细胞,血癌之骨髓侵犯率高,治疗前乳酸脱氢酶值升高或肾功能低下),则必须考虑采取额外的措施,包括增加临床实验室评估及降低VENCLEXTA的起始剂量。
【不良反应】
在CLL/SLL中,与奥滨尤妥珠单抗(obinutuzumab)或利妥昔单抗(rituximab)联合使用或作为单一治疗时,VENCLEXTA最常见的不良反应(≥20%)为中性粒细胞减少、血小板减少、贫血、腹泻、恶心、上呼吸道感染、咳嗽、肌肉骨骼疼痛、疲劳和水肿。
在AML中,与阿扎胞苷(azacytidine)、地西他滨(decitabine)或小剂量阿糖胞苷(cytarabine)联合使用的最常见不良反应(≥30%)为恶心、腹泻、血小板减少、便秘、中性粒细胞减少、发热性中性粒细胞减少、疲劳、呕吐、水肿、发热、肺炎、呼吸困难、出血、贫血、皮疹、腹痛、脓毒症、肌肉骨骼痛、头晕,咳嗽,口咽痛和低血压。
【药理作用】
维奈克拉是选择性的、口服可吸收的 BCL2(一种抗凋亡蛋白)小分子抑制剂。已有研究显示 BCL-2 在 l 细胞和 AL 细胞内过度表达,介导肿瘤细胞的存活,并与化疗药物耐药性相关。维奈克拉通过直接与 BCL-2 蛋白结合,取代促凋亡蛋白(如 BM)与 CL-2 蛋白的结合,引发线粒体外膜通透性增加和半胱天冬酶的活化,帮助恢复凋亡过程非临床研究显示,维奈克拉对过度表达 BCL-2 的肿瘤细胞有细胞毒活性。
【贮藏】
密封,不超过 30°C 保存。
免责声明:由本文所表达的任何关于疾病的建议都不应该被视为医生的建议或替代品,请咨询您的治疗医生了解更多细节。本站信息仅供参考,药得不承担任何责任。